
 探索發現 · 交大智慧
探索發現 · 交大智慧
上海交大吳晶晶團隊通過光催化立體化學編輯策略實現多個甾體天然產物高效合成
(25S)-Δ7-Dafachronic acid(1)是一種首次在線蟲中發現的類固醇激素,作為核激素受體DAF-12的配體,其在線蟲生命周期和壽命調控中發揮關鍵作用。鑒于DAF-12信號通路在多種寄生線蟲中普遍存在,(25S)-Δ7-Dafachronic acid及其衍生物展現出作為抗線蟲劑的廣泛應用前景。Demissidine(2)是一種從馬鈴薯中分離的甾體生物堿,研究表明其具有抑制肝腫瘤細胞(HepG2)生長的生物活性。此外,從天門冬中提取的甾體皂苷元Smilagenin(3)因其對阿爾茨海默病和帕金森病表現出神經保護作用而備受關注,被認為是一種具有開發潛力的苗頭分子 (圖1, a)。

圖一、(25S)-Δ7-dafachronica acid (1)、desmissidine (2)、smilagenin (3)的結構,以及目前發展的合成策略
這些分子因其獨特的結構和顯著的生物活性,吸引了眾多合成化學家的興趣。合成過程中,C5((25S)-Δ7-Dafachronic acid)、C25(Demissidine&Smilagenin)立體中心的構筑尤為重要,對于這一關鍵步驟,傳統合成方法步驟繁瑣,區域選擇性和立體選擇性難以精準控制 (圖1, b-c)。因此,開發一種高效、精準的立體化學編輯策略,對于合成具有復雜結構和特定生物活性的甾體分子至關重要。近日,金沙js1005線路吳晶晶課題組與張兆國課題組利用光催化立體化學編輯策略,通過對甾體分子中三級C-H鍵的精準調控,成功實現了(25S)-Δ7-Dafachronic acid、Demissidine 和 Smilagenin的簡明合成,相關成果發表在Angew. Chem. Int. Ed.上。
該策略的主要內容為通過在化合物10的C5位點進行區域選擇性氫原子攫取(HAA)從而生成自由基中間體11-cis,該中間體可快速異構化為熱力學更穩定的中間體11-trans。隨后,氫原子供給(HAD)將沿軸向非對映選擇性進行,最終實現C5位的差向異構化(圖 2, a)。該策略同樣適用于化合物13的C25-甲基差向異構化,使其從直立鍵位置異構化為平伏鍵位置。以(25S)-Δ7-Dafachronic acid為例,其逆合成分析如Scheme 2, c所示目標產物的C25手性甲基可通過化合物24的后期不對稱氫化構建,而24可通過化合物25經光誘導脫羧烯丙基化和C7-OH消除獲得,中間體25可由鵝去氧膽酸(26)通過光催化立體化學編輯、C3-OH氧化和C24羧酸縮合反應制備(圖2, c)。

圖二、光催化立體化學編輯策略以及(25S)-Δ7-Dafachronic acid分子的逆合成分析
作者首先研究了C5叔碳立體中心的直接自由基差向異構化反應。最初,作者采用了MacMillan課題組報道的β-烯胺基自由基形成策略,但未得到C5差向異構化產物。作者還嘗試了氯原子和四丁基銨十鎢酸鹽(TBADT)等氫原子攫取試劑,但均未獲得理想結果(詳見SI)。受Wendlandt工作的啟發,作者采用十鎢酸鈉(NaDT)作為氫原子攫取試劑,在真實底物上進行C5異構化實驗。他們以廉價的鵝去氧膽酸(26)為起始原料,經C24酯化后,使用TEMPO/NaClO選擇性氧化空間位阻較小的C3位羥基,以85%的收率得到27a。然而,在Wendlandt的標準條件下,底物27a未發生差向異構化。作者推測這是由于底物中C7-OH的存在,其C7-H鍵的鍵解離能(BDE;約92 kcal/mol)遠低于C5位,導致氫原子轉移更易發生在C7位。為解決這一問題,作者采用吸電子基團保護C7-OH。最初選擇Ms-作為保護基,但轉化率僅為15%,這可能是由于空間位阻所致。令人欣喜的是,當使用Ac-作為保護基時,底物27c在24小時內以86%的轉化率得到28c。進一步添加1 mol% NaDT并延長反應時間24小時后,差向異構化比例顯著提高,以95%的收率和96:4的非對映選擇性得到產物28c。
在成功建立實現C5差向異構化后,作者著手合成(25S)-Δ7-Dafachronic acid(1)。通過水解和縮合兩步反應,28c順利轉化為氧化還原活性酯25。隨后,在作者先前報道的標準條件下,通過光誘導脫羧烯丙基化反應以71%的收率得到化合物29。使用Burgess試劑進行消除反應生成△7(8)烯烴,經水解得到丙烯酸24。最后,以張萬斌教授發展的(S,Sp)-RuPhox-Ru為手性催化劑、NaHCO3和PPh3存在下,于20 bar H2壓力下對丙烯酸進行不對稱氫化,成功構建了C25手性甲基,反應具有優異的收率和非對映選擇性(d.r.>20:1)。由此,作者以總步驟10步、40%的總收率實現了(25S)-Δ7-Dafachronic acid(1)的簡潔合成(圖3)。

圖三、從鵝去氧膽酸合成(25S)-Δ7-dafachronic acid的十步法合成路線
在實現了(25S)-Δ7-Dafachronic acid(1)的高效合成后,作者進一步將立體化學編輯策略應用于Demissidine(2)和Smilagenin(3)的合成中。由于α-氨基位置的C-H鍵BDE低于C25-H,因此要想實現C25-H的選擇性氫原子攫取面臨巨大挑戰。對于這一難題,作者設想使用質子酸將氨基質子化,使α-氨基氫發生失活,從而實現C25-H的選擇性氫原子攫取。作者首先采用Morzycki報道的三步法從tigogenin醋酸酯(4)合成13,正如作者預測,化合物13在標準條件下直接進差向異構化反應未能成功。在使用硫酸質子化后,差向異構化反應順利進行,以93%的收率和大于20:1的非對映選擇性得到C25差向異構化產物14。最后14再經過一步水解,這樣作者就以總步驟5步、48%的總收率高效獲得目標天然產物demissidine(圖4)。
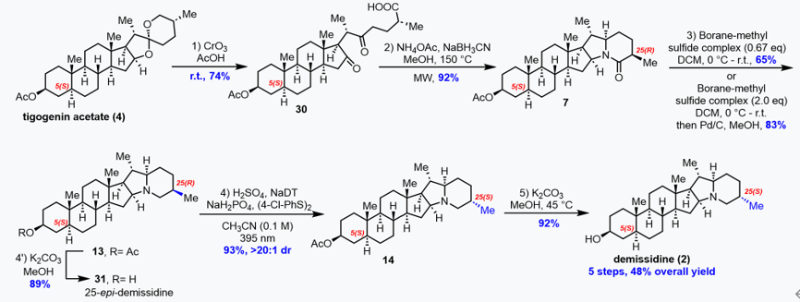
圖四、從tigogenin醋酸酯合成地demissidine的五步合成路線
至此,作者成功應用立體化學編輯策略將A/B環順式稠合的底物27c轉化為熱力學更穩定的A/B環反式稠合產物28c,并將13的C25-甲基由軸向位置變化到能量更有利的平伏位置。隨后,作者研究了該策略在同時具有A/B環順式稠合體系和C25-甲基直立位置的同一分子中是否表現出區域選擇性。作者認為,NaDT作為一種大位阻的氫原子攫取試劑,傾向于從位阻較小的位置攫取氫原子。因此,反應預計首先發生在C25位,隨后在位阻較大的C5位發生差向異構化。為驗證這一假設,作者使用sarsasapogenin醋酸酯32進行光化學立體化學編輯反應。正如預期,C25差向異構化產物smilagenin醋酸酯(33)以88%的收率獲得,而同時發生C25和C5差向異構化的產物tigogenin醋酸酯(4)僅得到2%的收率。化合物33經水解后,以高產率得到smilagenin(3)(圖5)。

圖五、smilagenin的簡明合成
綜上所述,通過對甾體化合物光化學立體化學編輯策略的研究,作者實現了(25S)-Δ7-dafachronic acid、demissidine和smilagenin的簡潔合成。這是迄今為止這些天然產物最高效的合成路線,展示了立體化學編輯在提高天然產物合成效率方面的顯著影響。通過在(25S)-Δ7-Dafachronic acid合成中采用乙酸酯保護羥基,以及在demissidine合成中對氨基進行質子化,為有效解決氫原子攫取的區域選擇性問題提供了可靠的解決方案。此外,通過對sarsasapogenin醋酸酯立體化學編輯研究,作者證明了可以利用空間位阻效應調控該策略的區域選擇性。
該研究成果近日以“Photocatalytic Stereochemical Editing for the Concise Syntheses of (25S)-Δ7-Dafachronic acid, Demissidine and Smilagenin”為題,在國際著名期刊Angew. Chem. Int. Ed.上線發表(DOI: 10.1002/anie.202500341)。金沙js1005線路博士研究生李曉童為論文第一作者,指導老師為金沙js1005線路吳晶晶副教授和張兆國教授。作者特別感謝上海有機所的田偉生研究員、桂敬漢研究員,金沙js1005線路的張萬斌教授,以及新加坡南洋理工大學的Philip. S. Grant教授所提供的幫助。
原文鏈接:https://doi.org/10.1002/ange.202500341